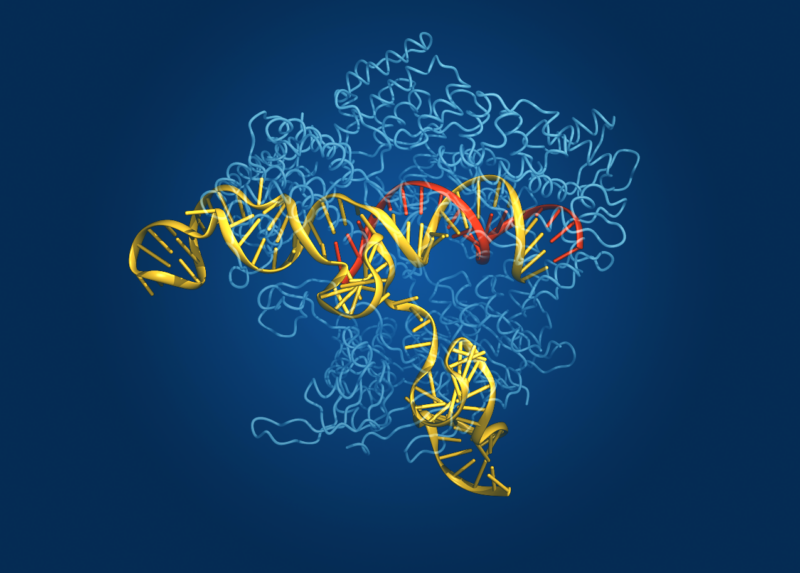
CRISPR — кластеризованные короткие палиндромные повторы с регулярными интервалами — это ответ микробного мира на адаптивный иммунитет. Бактерии не вырабатывают антитела, когда в них вторгаются патогены, а затем не блокируют эти антитела, если они снова сталкиваются с тем же патогеном, как это делаем мы. Вместо этого они интегрируют часть ДНК патогена в свой геном и прикрепляют ее к ферменту, который они могут использовать для распознавания последовательности ДНК патогена и разрезания ее на части, если патоген появится снова.
Фермент, который разрезает, называется Cas, в честь CRISPR. Хотя система CRISPR-Cas развивалась как механизм защиты бактерий, исследователи использовали и адаптировали ее как мощный инструмент для генетических манипуляций в лабораторных исследованиях. Он также доказал свою эффективность в сельском хозяйстве, и первый метод лечения на основе CRISPR был одобрен в Соединенном Королевстве для лечения серповидно-клеточной анемии и трансфузионно-зависимой бета-талассемии.
Теперь исследователи разработали новый способ поиска в геномах CRISPR-Cas-подобных систем. Они обнаружили, что у нас может быть много дополнительных инструментов для работы.
Модификация ДНК
На сегодняшний день у разных микробов идентифицировано шесть типов систем CRISPR-Cas. Хотя они различаются в деталях, все они имеют одну и ту же привлекательность: они доставляют белки к определенной последовательности генетического материала со степенью специфичности, достижение которой до сих пор было технически сложно, дорого и отнимало много времени. Любая интересующая последовательность ДНК в системе может быть запрограммирована и нацелена.
Нативные системы микробов обычно вводят в последовательность экзонуклеазу — фермент, расщепляющий ДНК, измельчая генетический материал патогенов. Эту способность можно использовать для вырезания любой выбранной последовательности ДНК для редактирования генов; В сочетании с ферментами и/или другими последовательностями ДНК его можно использовать для вставки или удаления дополнительных коротких последовательностей, а также для коррекции мутантных генов. Некоторые системы CRISPR-Cas разрезают определенные молекулы РНК вместо ДНК. Их можно использовать для устранения болезнетворных РНК, например, из геномов некоторых вирусов, так же, как они удаляются из местных бактерий. Это также можно использовать для устранения дефектов обработки РНК.
Но существует множество дополнительных способов модификации нуклеиновых кислот, которые могут оказаться полезными. Вопрос о том, появились ли ферменты, производящие дополнительные модификации, остается открытым. Поэтому некоторые исследователи решили их поискать.
Исследователи из Массачусетского технологического института разработали новый инструмент для обнаружения вариантов массивов CRISPR и применили его к 8,8 тера (1012) пар оснований геномной информации прокариот. Многие из обнаруженных ими систем редки и появились в наборе данных только за последние 10 лет, что подчеркивает, насколько важно продолжать добавлять в эти хранилища данных ранее труднодоступные образцы окружающей среды.
Новый инструмент был необходим, потому что базы данных последовательностей белков и нуклеиновых кислот расширяются с невероятной скоростью, поэтому методы анализа всех этих данных должны идти в ногу со временем. Некоторые алгоритмы, используемые для их анализа, пытаются сравнить каждую последовательность с любой другой последовательностью, что явно несостоятельно при работе с миллиардами генов. Другие полагаются на кластеризацию, но находят только очень похожие гены, поэтому не могут пролить свет на эволюционные взаимоотношения между отдаленно родственными белками. Но быстрая, чувствительная к местоположению кластеризация на основе хэштегов («флэш-сборка») работает путем группировки миллиардов белков в меньшие и большие наборы последовательностей, которые отличаются лишь незначительно, чтобы идентифицировать новых и редких родственников.
Поиск с использованием FLSHclust успешно выявил 188 новых систем CRISPR-Cas.
Много CRISPyness
Некоторые темы возникли в результате работы. Во-первых, некоторые из недавно идентифицированных систем CRISPR используют ферменты Cas с ранее не встречавшимися доменами или представляют собой слияния с известными генами. Ученые также охарактеризовали некоторые из этих ферментов и обнаружили, что один из них более специфичен, чем ферменты CRISPR, используемые в настоящее время, а другой разрезает РНК, которая, по их мнению, структурно достаточно отлична, чтобы включать совершенно новую систему CRISPR-Cas 7-го типа.
Следствием этой темы является связывание ферментов с различными функциями, а не только нуклеаз (ферментов, разрезающих ДНК и РНК), с массивами CRISPR. Ученые использовали замечательную способность CRISPR воздействовать на гены, присоединяя его к другим типам ферментов и молекул, таким как флуоресцентные красители. Но, очевидно, эволюция добралась туда первой.
Например, FLSHclust идентифицировал нечто, называемое транспозазой, которая связана с двумя разными типами систем CRISPR. Транспозаза — это фермент, который помогает перенести определенную часть ДНК в другую часть генома. Трансформация, направленная на РНК CRISPR, наблюдалась и раньше, но это еще один пример. Был обнаружен целый ряд белков с различными функциями, таких как белки с трансмембранными доменами и сигнальные молекулы, связанные с массивами CRISPR, что подчеркивает смешанный характер эволюции этих систем. Они даже обнаружили белок, экспрессируемый вирусом, который связывается с массивами CRISPR и делает их неактивными, при этом вирус фактически отключает систему CRISPR, которая эволюционировала для защиты от вирусов.
Исследователи не только обнаружили новые белки, связанные с массивами CRISPR, но также обнаружили другие массивы регулярно расположенных повторов, которые не были связаны ни с какими ферментами Cas, подобно CRISPR, но не CRISPR. Они не уверены в функции этих РНК-управляемых систем, но предполагают, что они участвуют в защите так же, как CRISPR.
Авторы задались целью найти «список белков, управляемых РНК, который расширит наше понимание биологии и эволюции этих систем и станет отправной точкой для разработки новых биотехнологий». И, похоже, они достигли своей цели: «Результаты этой работы демонстрируют беспрецедентную нормативную, функциональную гибкость и модульность систем CRISPR», — пишут они и заключают: «Это лишь малая часть обнаруженных систем, но это подчеркивает широту неиспользованного потенциала биоразнообразия Земли». Остальные кандидаты послужат ресурсом для будущих исследований.
DOI статьи: 10.1126/science.adi1910

«Наркоман поп-культуры. Поклонник телевидения. Ниндзя алкоголика. Абсолютный фанат пива. Профессиональный знаток твиттера».





More Stories
SpaceX успешно запустила группировку навигационных спутников для Евросоюза
Замечена пара массивных плазменных струй, вылетающих из гигантской черной дыры Черные дыры
Драматические изображения гигантской полнолуния и частичного лунного затмения